

BMK-R001 脂肪幹細胞分離キット
BMK-R004 脂肪幹細胞分離キット(アニマルフリー・アルブミンフリー)
BMK-S100 間葉系幹細胞分離増殖キット(アニマルフリー・アルブミンフリー)
ヒトの脂肪、臍帯組織から幹細胞を簡単に分離できるキット
1キットにつき5回分の分離操作が可能
特長
・操作が短時間で簡単に行える
組織を細かくして幹細胞分離基材に載せて培養するだけ
・少量の組織があれば分離可能
米粒大程度(約20mg)のヒト脂肪や臍帯、骨髄、歯髄等の組織、ヒト脂肪吸引破砕物(約0.5mL)から幹細胞を分離可能
・高純度の幹細胞
分離基材から回収した細胞を脂肪細胞分化誘導培地で培養した際、80%以上の細胞が脂肪細胞に分化したことを確認
・細胞へのダメージが少ない
コラゲナーゼを使用しないため、細胞へのダメージを最小限に抑えられる
・基材に接着した幹細胞はトリプシン処理で剥離可能
・顕微鏡で幹細胞の増殖が観察できる
増殖を経過観察できるため、幹細胞を回収するタイミングがわかりやすい
・間葉系幹細胞の分離、増殖に特化した培地
血清添加済の培地、またはご自身で選択した血清を添加して使用する培地(=アルブミンフリー)を選択
・分化能と細胞表面マーカーの保持を確認
BMK-R001
BMK-S100
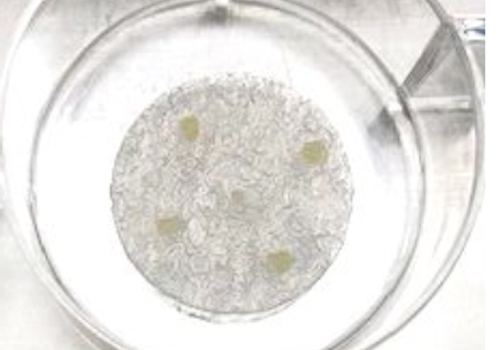
幹細胞分離基材について
・少量のヒトの脂肪や臍帯、骨髄、歯髄などの組織から幹細胞を分離することができる不織布のこと
・PE-PPの芯鞘構造をもつ不織布にハイドロキシアパタイトを塗布しており、この基材の上にヒト脂肪組織を載せて培養することで、細胞外マトリックスを豊富に産生するヒト脂肪幹細胞(ASC)が分離できます。

使用方法(簡易ver.)
※作業は安全キャビネット等の無菌環境下で行ってください。
※ピンセット、ディッシュ、培養器具等が必要となります。
<基材の親水化処理>
分離基材親水化処理方法の動画をご用意しておりますので下記を参考にしてください。
<初代培養>
- 基材を親水化処理して、6ウェルプレートに入れる。
- 脂肪組織または脂肪吸引物を生理食塩水(またはPBS)で洗浄後、基材の上に載せる。
脂肪吸引物の場合は、付属のセルストレーナーの上に基材を載せてから脂肪吸引物を載せる。 - 培地を1ウェルにつき5mL添加し、分離基材が培地に浸るようにする。
- 37℃インキュベーターで10~14日間培養する。
- 脂肪幹細胞が分離基材の10~20%程度占めるようになったら、細胞を回収する。
<細胞回収、継代>
- 細胞がOutgrowthした基材を50mLコニカルチューブに移し、約10mLの生理食塩水またはPBS(-)で2回洗浄する。
同じ検体(脂肪組織)を載せている基材が複数ある場合は基材2枚につき1本の50mLコニカルチューブにまとめても可。 - 基材の入ったコニカルチューブに基材1枚あたり約1mLの細胞剥離液(トリプシンEDTAなど)を加え、基材が浸るようにする。
- 室温で5~10分程度インキュベートすると細胞が剥がれるので、約20~30mLの生理食塩水またはPBS(-)を入れ、十分に転倒混和させる。
※剥がれない細胞もあるため、10分経過したら剥がれた細胞のみ回収してください。 - 基材を除き、室温で1,200rpm、3分間遠心分離する。
- 得られた細胞ペレットに、調製した脂肪幹細胞用の増殖培地を加え、ピペッティングして、細胞数をカウントする。
製品データ
hASC・・・・・ヒト脂肪由来幹細胞
細胞形態・増殖能
幹細胞分離基材を使用して、ヒト脂肪組織を培養した際のhASC(ヒト脂肪由来幹細胞)の増殖を確認した。
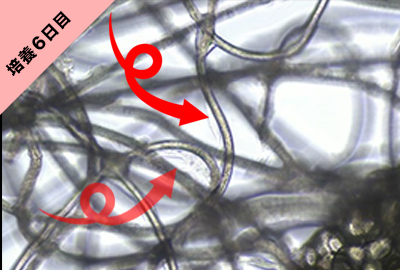
培養5~6日目から基材の線維に沿ってoutgrowthしているhASCの存在が確認できる。細胞が少ないと見つけるのが難しい。
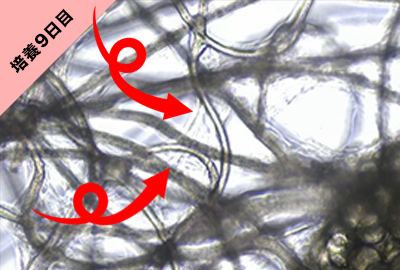
培養9~10日経過すると、hASC が基材に沿ってoutgrowthしていることがはっきりと確認できる。

培養10~14日経過すると基材全体に増殖する。基材全体の10~20%程度hASCが占めるようになったら基材からASCを回収する。
分化能
6継代後のhASCとhWJ-MSCを脂肪細胞、 骨芽細胞、軟骨細胞に分化誘導して染色し た結果、各細胞に分化した。
(写真はhASCから各細胞に分化誘導して染色した写真)
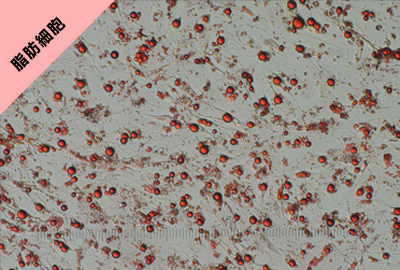
Oil Red

Alizarin Red

Alcian Blue
●各キットに付属する培地の違い
幹細胞分離基材(5枚)とセルストレーナー(5個)は共通で、培地の種類と量が異なります(※表は横スクロールします)
| 製品名 | 脂肪幹細胞分離キット | 脂肪幹細胞分離キット (アニマルフリー・アルブミンフリー) |
間葉系幹細胞分離増殖キット (アニマルフリー・アルブミンフリー) |
|---|---|---|---|
| 付属培地 | 脂肪幹細胞分離培地:100mL | BSCM-SP1 間葉系幹細胞分離培地:100mL | BSCM-SP1 間葉系幹細胞分離培地:100mL BSCM-PL1 間葉系幹細胞増殖培地:200mL |
| 抗生剤 | 抗生物質添加済(ペニシリン:100μg/mL、ストレプトマイシン:100μg/mL、アムホテリシン:0.25µg/mL) | ||
| 血清 | FBS1%添加済(USDA認証) | なし (ご自身でご用意した血清を2~5%添加してください) |
なし (ご自身でご用意した血清を2~5%添加してください) |
| 色 | フェノールレッド | 無し(若干黄色味がかっています) | 無し(若干黄色味がかっています) |
| 安全性 | 血清配合 | アニマルフリー、アルブミンフリー | アニマルフリー、アルブミンフリー |
| おすすめ |
|
|
|
| 全キット共通のおすすめ |
|
||
製品内容
キットに含まれる培地は、FBS(1%)が添加されている培地(BMK-R001)とご自身で用意した血清を添加して使用するアルブミンフリー(アニマルフリー)培地(BMK-R004)の2種類から選択できます。
| 製品名 | 脂肪幹細胞分離キット | 脂肪幹細胞分離キット (アニマルフリー・アルブミンフリー) |
間葉系胞分離増殖キット (アニマルフリー・アルブミンフリー) |
|---|---|---|---|
| 製品番号 | BMK-R001 | BMK-R004 | BMK-S100 |
| 内容物 | 脂肪幹細胞分離培地:100mL 幹細胞分離基材:5枚 セルストレーナー:5個 |
BSCM-SP1 間葉系幹細胞分離培地 (アルブミンフリー):100mL 幹細胞分離基材:5枚 セルストレーナー:5個 |
BSCM-SP1 間葉系幹細胞分離培地 (アルブミンフリー):100mL BSCM-PL1 間葉系幹細胞増殖培地:200mL 幹細胞分離基材:5枚 セルストレーナー:5個 |
| 保存 | 冷蔵 | 冷蔵 | 冷蔵 |
| 希望販売価格(税抜) | 45,000円 (お問い合わせください) | 45,000円 (お問い合わせください) | 59,000円 (お問い合わせください) |
製品使用文献
SOCS7-Derived BC-Box Motif Peptide Mediated Cholinergic Differentiation of Human Adipose-Derived Mesenchymal Stem Cells
Int J Mol Sci. 2023 Feb; 24(3): 2786. doi: 10.3390/ijms24032786
PubMed
Surgical implantation of human adipose derived stem cells attenuates experimentally induced hepatic fibrosis in rats
Mol Med. 2022; 28: 143. doi: 10.1186/s10020-022-00566-6
PubMed
Hepatic phosphatidylcholine catabolism driven by PNPLA7 and PNPLA8 supplies endogenous choline to replenish the methionine cycle with methyl groups
Cell Rep. 2023; 42(2):111940. doi: 10.1016/j.celrep.2022.111940.
PubMed
Therapeutic effect of intravenously administered autologous adipose-derived stem cells on chronic stage stroke patients.
Int J Stem Cell Res Ther. 2020; 7(1):070. doi: 10.23937/2469-570X/1410070.
ClinMed
Cytoprotective effects of mesenchymal stem cells during liver transplantation from donors after cardiac death in rats.
Transplant Proc. 2018; 50(9):2815-2820. doi: 10.1016/j.transproceed.2018.02.180.
PubMed
Effect of an intravenous administration of adipose-tissue-derived autologous stem cells on the skin temperature of paralyzed limbs of stroke patients.
Ann Clin Med Case Rep. 2023; 10(13):1-9. Available from:
PDF
A single intradermal injection of autologous adipose-tissue-derived stem cells rejuvenates aged skin and sharpens double eyelids.
J Pers Med. 2023; 13(7):1162. doi: 10.3390/jpm13071162.
PubMed
Extracellular vesicles derived from adipose-derived mesenchymal stem/stromal cells prevent synovial inflammation and attenuate cartilage degeneration in rodent osteoarthritis
Regen Ther. 2026 Jan 3;31:101056. doi:
PubMed

